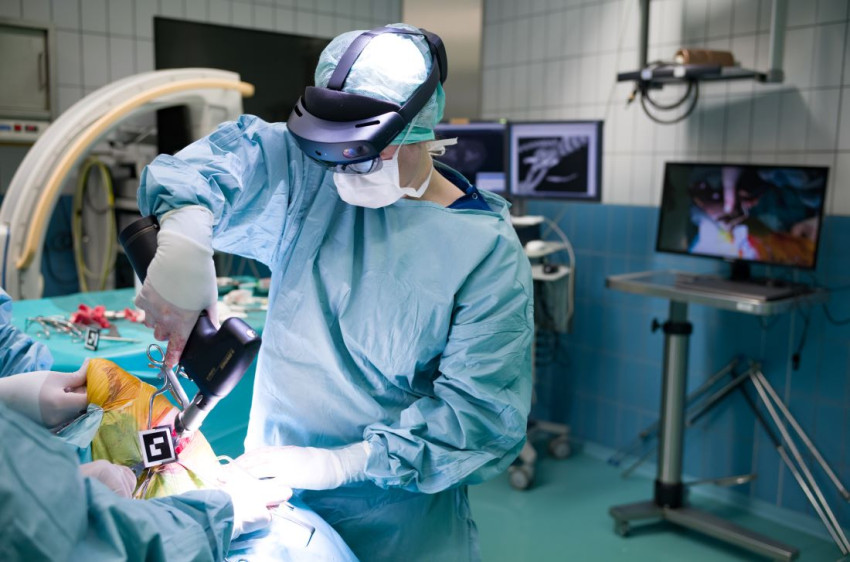
Meer controle over 3D-geprinte bloedvaten
Van gekweekt weefsel zijn met een 3D-printer organen na te maken. Die hebben dan wel bloedvaten nodig om het weefsel van zuurstof en voeding te voorzien. Onderzoekers van de Universiteit Twente ontwikkelden een bio-inkt waarmee ze de groei van een bloedvatnetwerk in geprint weefsel kunnen aansturen.
De laatste jaren lukt het steeds beter: organen namaken met uit cellen gekweekt levend weefsel. Met behulp van speciale 3D-printers kan dit weefsel in de gewenste vorm worden gebracht, zodat artsen er hopelijk in de toekomst kapotte hartkleppen mee kunnen repareren, of onderzoekers er medicijnen op kunnen uittesten zodat er minder proefdieren nodig zijn.
Om de geprinte organen in leven te houden, moet het weefsel echter wel van voldoende voeding en zuurstof worden voorzien en afvalstoffen kunnen afvoeren. Daarvoor zijn, net als bij echte organen, bloedvaten nodig. Er bestaan al wel technieken om bloedvaten als een soort buisjes in een orgaan te printen. Maar een fijnmazig netwerk maken door het hele weefsel heen, is nog niet echt gelukt.
Bio-inkt
Hiervoor hebben onderzoekers van de Universiteit Twente nu een speciaal materiaal ontwikkeld. Zij presenteren een ‘bio-inkt’ waarmee de vorming van kleine bloedvaatjes in 3D-geprinte weefsels te sturen is – niet alleen wat betreft hun locatie, maar ook wat betreft hun groei in de loop van de tijd. Deze bloedvaatjes bootsen de complexe netwerken na die we in het lichaam vinden, schrijft de Universiteit Twente in een nieuwsbericht. Het team publiceerde de onderzoeksresultaten begin deze maand in het vakblad Advanced Healthcare Materials.
‘De bio-inkt die we maakten is een hydrogel’, zegt onderzoeker Jeroen Rouwkema van het Vascularization Lab van de Universiteit Twente, die het onderzoek leidde. ‘Je kunt het voor je zien als een gelatinepudding.’
Aan die gel voegden de onderzoekers aptameren toe, stukjes DNA die bepaalde eiwitten aan zich kunnen binden. Rouwkema: ‘In dit geval zijn dat eiwitten die de groei van bloedvaten stimuleren. Door bepaalde gebieden in de gel wel van aptameren te voorzien en andere niet, kunnen we dus zelf bepalen waar de bloedvaten zich vooral zullen ontwikkelen.’ In het menselijk lichaam werkt het net zo. Daar is de directe omgeving van weefsels een reservoir voor groeisignalen, die alleen worden vrijgegeven wanneer nodig.
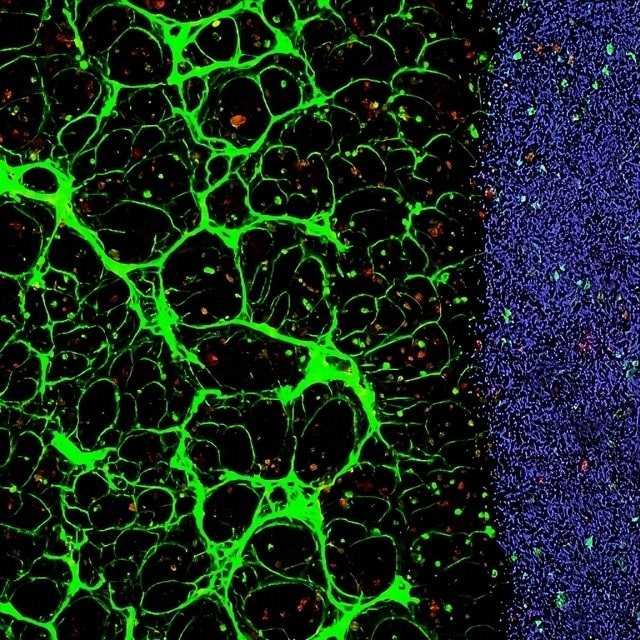
Zonder de aptameren vormen de bloedvaten via zelforganisatie een willekeurig patroon. Het verschil is goed te zien in de afbeelding (zie boven), waar het blauwgestippelde deel rechts de gel zonder aptameren laat zien en het groene deel links de gel met aptameren. De draderige structuur in het groene gedeelte is het bloedvatenstelsel.
Toekomst
En wat gaat dit soort onderzoek in de toekomst opleveren? ‘Vroeger werd wel geroepen dat we hiermee straks geen donororganen meer nodig hebben’, zegt Rouwkema. ‘Maar dat lijkt mij nogal voorbarig. Ik zie eerder voor me iemand na een hartinfarct een nieuw stukje hartspierweefsel kan krijgen. Of dat er nieuw bot mee wordt gemaakt, want daarvoor is het zeer geschikt.’
Openingsfoto: Jeroen Rouwkema, Universiteit Twente